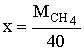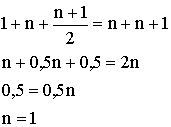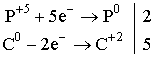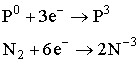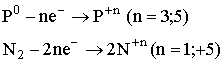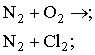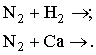|
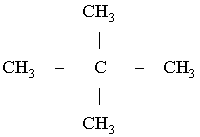
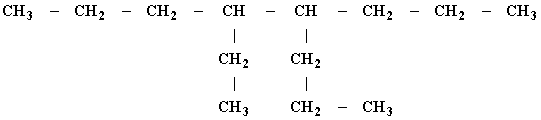
Диплом: Формирование у учеников ответственного отношения к учебе во время самостоятельной работы 3. Як здійснити такі перетворення: CH4®C®CH4®CH3Cl? Варіант С. 1. Написати стурктурні формули алканів, які мають такий елементний склад: C – 82,76%, H – 17,24%. 2. Написати структурні формули вуглеводнів: а) 2-метилбутану; б) 2,2- диметилбутану. 3. Зазначити тип гібридизації орбіталей кожного з атомів вуглецю в молекулі пентану CH3 – CH2 – CH2 – CH2 – CH 3. Розв’язки завдань для контрольної роботи. 1. Загальн формула алканів CnH2n+2. Складаємо рівняння: 12 n + 2n +2 = 44; n=3 (C3H8) 2. 3.Загальна формула алкану CnH2n+2 Формула алкану C4H10. Структурні формули: СН3 – СН2 – СН2 – СН2 – СН3; Т’юторські завдання. Творчі. 1. Чому атоми вуглецю можуть сполучатися між собою, утворюючи ланцюги? Обгрунтувати відповідь. 2. З електронної будови атома вуглецю виходить, що в сполуках він повинен бути завжди двохвалентний (наявність двох неспарених р-електронів). У молекулі ж метану вуглець чотирьохвалентний. Як пояснити цю суперечність? 3. Який об’єм кисню потрібний для спалювання 40л суміші метану з етаном, густина якої за воднем 13,25? 4. Визначте загальну формулу співвідношення сумарного об’єму алкану і кисню, необхідного для повного йо7го згорання, до сумарного його об’єму продуктів реакції. Для якого насиченого вуглеводню це співвідношення дорівнює 1? Обов’язкові. Варіант А. 1. Складіть структурні формули таких сполук: а) 4-етил-2-метилгексану; б) 2,2,3-триметилбутану. 2. Насичений вуглеводень має відносну густину пари за повітрям 4,414. Визначте молекулярну формулу вуглеводню. 3. Який зв’язок називаться s-зв’язком, які його особливості? Варіант В. 1. Назвіть за систематичною номенклатурою насичений вуглеводень, головний ланцюг якого має чотири атоми вуглецю, а відносна молекулярна маса дорівнює 114. 2. Ізомерами є: а) 2-метилгексан та 3-етілгесан; б) 3-етилгексан та 2,3- диметилгептан; в) 2,3-диметилгептан та 3-етил-3-метилгексан; г) 3-етил-3- метилгексан та 2-метилгексан. 3. Яку просторову форму мають молекули насичених вуглеводнів: а) зигзагоподібну; б) лінійну; в) площинну? Варіант С. 1. У чому суть sp3-гібридизації? 2. Яка довжина зв’язку С – С; валентний кут в молекулах алканів: а) 0,140нм,; б) 0,154нм, 109º28’; в) 0,120нм, 180º; г) 0,134нм, 120º? 3. Напишіть скорочену структурну формулу 3-етил-2-метилпентану. Розв’язки творчих завдань. 1. Молекулярна маса суміші якщо метану в суміші х літрів, то його мольна доля , а етану , СH4 + 2O2 ® CO2 + 2H2O 2C2H6 + 7O2 ® 4CO2 + 6H2O. Для горіння метану потрібно 20л кисню, а етану – 105л. загальна кількість кисню – 135л. 2. СnH2n+2 + [n + (n + 1) / 2]O2 ® nCO2 + (n + 1)H2O Загальний склад алкану і кисню: Загальна формула: CH4 – це метан. Під час проходження педагогічної практики в загальноосвітній школі І‑ІІІ ступенів № 20 м.Полтави, в 10-А класі нами був проведений педагогічний експеримент. Його завданням було виявити переваги технології модульно-рейтингового навчання над існуючою традиційною технологією, яка побудована на пасивних інформаційних змістові і методах навчання і не стимулює систематичну самостійну навчальну діяльність учнів. Поставивши за мету формування самостійності, як центральної риси особистості учня, в результаті експериментальної роботи ми прийшли довисновку, що для досягнення цієї мети необхідне оптимальне поєднання різних форм самостійної роботи: індивідуальних, групових і фронтальних, тобто досягнення їх гармонізації. Гармонія, гармонійність (від грецького armonia -злагодженість, зв’язок, стрункість) – внутрішня і зовнішня упорядкованість, узгодженність, цілісність явищ і процесів [8]. Під гармонізацією ми розуміємо педагогічно доцільне співвідношення різних форм самостійної роботи: фронтальної, групової та індивідуальної, що забезпечують індивідуалізацію навчання, яка створює передумови для розвитку інтересів і здібностей особистості, збереження і подальшого виховання творчої індивідуальності. Фронтальна діяльність полягає у виконанні всіма учнями під безпосереднім керівництвом вчителя спільних завдань (контролюючих) [2, 37, 49]. Хоча завдання ставить для всіх учнів, але в умовах модульно-рейтиногового навчання кожний має можливість працювати за індивідуальним стилем діяльності, власними темпами. Групову навчальна діяльність ми розглядаємо як сукупну навчальну діяльність невеликих за складом груп учнів. Досягнення загальної мети групової діяльності відбувається завдяки спільним зусиллям окремих членів групи. вІдмінною рисою групової діяльності є можливість учитися не лише з підручником та у викладача, а й один у одного. Індивідуальна навчальна діяльність – це одноосібне вирішення учнями навчальних задач, повна самостійність у набітті знань. Ця форма навчальної діяльності найбільш повно враховує індивідуальні особливості учнів, дає можливість вибору способів, прийомів, темпу навчання, що враховують рівень розвитку, розумових здібностей, особливості вищої нервової діяльності окремої особистості, сприяє формуванню і збереженню неповторної індивідуальної особистості кожного учня. Для педагогічного експерименту було взято два класи: 10-А клас (експериментальний) і 10-Б клас (контрольний). Перед запровадженням модульно-рейтингової технології навчання в обох класах були зроблені зрізи знань. Результати статистичного аналізу подані в таблицях. Рівень якості знань учнів до експерименту.
Рівень якості знань учнів після експерименту.
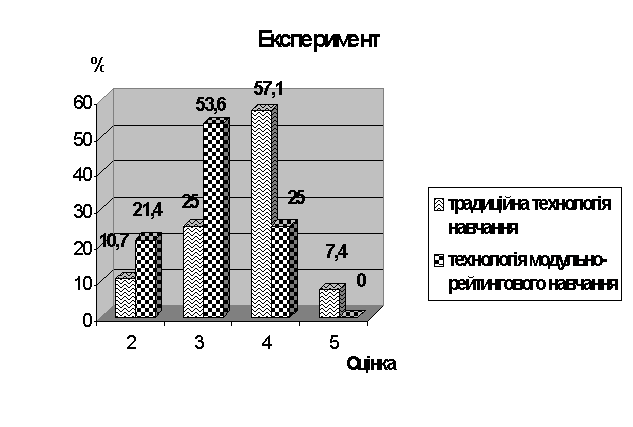
В експериментальному класі уроки хімії були “спареними”. Урок розпочинався з викладення нового матеріалу, на який вчитель відводив 20-25хв. Далі проводиться самостійна робота учнів з підручником, додатковою літературою. Учні дещо конспектують, дають відповіді на запитання в кінці параграфа, вивчають малюнки, схеми. Наступним етапом є виконання контролюючих завдань (25-30хв.), під час їх виконання учні можуть користуватися власним конспектом та підручником. Кожен учень при цьому може вибирати любий рівень складності. Так, варіант А – високий рівень складності. Завдання цього варіанту оцінюються 3 балами. Варіант В – середній рівень складності. Завдання оцінюються 2 балами. Варіант С – невисокий рівень складності. Завдання оцінюються 1 балом. Наступний етап – виконання т’єюторських (обов’язкових) завдань (20-25хв.). В нашому варіанті т’юторські завдання – це завдання для самостійної роботи, яка поділяється на обов’язкову і творчу (за бажанням і нахилами учнів). Обов’язкові завдання диференційовані. Вони поділяються на варіанти А – продуктивний, В – частково-пошуковий, С – репродуктивний рівень, які учні вибирабть добровільно. Виконуючи завдання, учень може одержати консультації у вчителя, учнів класу, але здає виконане завдання тільки індивідуально. Відбувається ніби індивідуальний захист власної творчої роботи. При цьому в учня виробляється вміння доказово й обгрунтовано відстоювати власну думку, вести діалог, грунтовно пояснювати доцільність тієї чи іншої дії. Крім того, захищаючи власну ідею, учень мусить добре орієнтуватись в науковій інформації, тобто, повинен систематично працювати з підручником, додатковою і науковою літературою. Т’юторські завдання оцінюються: А – 20 балами, В – 15 балами, С – 10 балами, творче завдання – 30 балами. Таким чином, виконуючи завдання т’юторських занять, учень передусім формує таку рису свого характеру як самостійність. Т’юторські завдання теж мають різний рівень складності і відповідну кількість балів. Завершується вивчення модуля контрольною роботою, яка проводиться в присутності вчителя за індивідуальними завданнями. В процесі проведення експерименту ми помітили, що спочатку учні ставляться до виконання завдань без особливого ентузіазму, формально, тобто лише як до засобу підвищення власної оцінки. Але після першого ж індивідуального спілкування з вчителем починають проявляти цікавість, адже їхніми власними судженнями цікавляться, вислуховують пропозиції, критичні зауваження. Учні займають позицію суб’єкта, активного учасника навчального процесу, відчувають відповідальність за кінцевий результат – рівень підготовки до вузу, розвиток себе як особистості. Проаналізувавши можливості технології модульно-рейтингового навчання, ми прийшли до висновку, що дана технологія навчання дозволяє індивідуалізувати навчально-виховний процес за: змістом навчання; темпом засвоєння знань і формування вмінь; стилем діяльності; контролем і самоконтролем; характером педагогічної взаємодіє вчителя і учнів. Впровадження описаної методики організації і оцінювання самостійної роботи сприяє підвищенню самостійності, відповідальноств за результати своєї праці, що впливає на вибір майбутньої професії, дає можливість створити умови для самореалізації учнів, вияву їх індивідуальних здібностей, стимулює творчу роботу на протязі чверті, індивідуалізує процес навчання в усіх формах навчальної діяльності. Висновки: 1. Традиційна технологія навчання, яка є основою в сучасній загальноосвітній школі і базується на інформаційній моделі освіти, втрачає свою актуальність. Адже в епоху науково-технічної революції об’єм навчальної інформації подвоюється кожні 10 років і ставити за мету засвоєння всієї інформації стає недоцільним. На перше місце виступає завдання розвитку особистості учня, який стає суб’єктом навчально-виховного процесу. 2. Завдання розвитку особливості дитини покликані виконати нові технології навчання, основним цінносним орієнтиром яких є учень, як унікальна і неповторна особистість. 3. Основним методом навчання стає не передача готової інформації від учителя до учня, а самостійна навчальна діяльність учнів. 4. Під самостійною роботою ми розуміємо таку форму організації процесу навчання, яка здійснюється з метою набування нових знань і вмінь у спеціаьно відведений час без безпосередньої участі вчителя, але під його керівництвом. 5. Основними умовами ефективного застосування самостійних робіт є: а) технологізація навчального процесу; б) створення бази дидактичного матеріалу для систематичної самостійної навчально-пізнавальної діяльності учнів; в) гармонізація індивідуальної, групової та фронтальної форм самостійної роботи; г) домінування творчих навчально-пізнавальних завдань над репродуктивними в процесі самостійної роботи учнів. 6. У процесі експериментальної роботи виявлено, що ефективною технологією навчання, яка ставить за мету розвиток особистості учня та формування самостійності, як риси характеру, є технологія модульно-рейтингового навчання. 7. Під технологією модульно-рейтингового навчання ми розуміємо таку технологію організації навчально-виховного процесу, що базується на індивідуалізації та диференціації навчання, забезпечує стимулюючу і розвиваючу функції одержаних знань, їх самостійність і мобільність у процесі особистісно-орієнтованого навчання. 8. Використання самостійної диференційованої роботи учнів у технології модульно-рейтингового навчання дає можливість індивідуального процесу навчання і ставить учнів в умову вільного вибору змісту хімічної освіти, методів та темпів навчання. 9. Результати педагогічного експерименту підтвердили ефективність застосування технолгії модульно-рейтингового навчання, яка бере за основу самостійну роботу учнів. Адже 21,4% учнів експериментального класу виявили знання на рівні оцінки “5”, 53,6% - “4”, 25% - “3”, тоді як в традиційній технолгії ці показники становлять: 13,8% - “5”, 48,3% - “4”, 37,9 – “3”. Міні-модуль. Тема: Нітроген і фосфор. Фізичні і хімічні властивості нітрогену і фосфору. Мета: освітня: виховна: формувати в учнів самостійність, як рису особистості. розвиваюча: розвивати вміння самостійно працювати з літературою, логічно мислити, робити узагальнення, порівняння, висновки. Методи і прийоми: бесіда, розповідь, демонстрація, самостійна робота з літературою. Обладнання: таблиця “Будова молекули нітрогену і фосфору”. План уроку. І. Організаційни момент. ІІ. Ознайомлення з основними поняттями теми. ІІІ. Самостійна робота з підручником да додатковою літературою. IV. Виконання контролюючих завань. V. Підведення підсумків уроку. VІ. Т’юторські завдання, їх інструктаж.
ІІІ. Завдання: самостійно опрацюйте застосування нітрогену і фосфору. Варіант А. До відповідних колонок таблиці запишіть рівняння реакцій, які б ілюстрували ці властивості. Складіть електронний баланс. Вкажіть назви продуктів реакції. Хімічні властивості нітрогену і фосфору.
2. Обчислити масову частку нітрогену у його вищому оксиді. Варіант В. 1. Охарактеризуйте хімічні елементи N і А за їх положенням у періодичній системі.
2. Закінчити рівняння реакцій: а) Варіант С. 1. Записати молекулярну, структурну та електронну формули азоту. 3. Реакція між азотом і воднем зображується таким термохімічним рівнянням: Пояснити, в який бік і чому станеться зміщення рівноваги: а) при збільшенні тиску; б) при підвищенні температури. Контролююча частина модулю. IV. Варіант А. 1. Запишіть рівняння реакцій таких перетворень: 2. При нагріванні технічного нітрату міді (ІІ) масою 75,2г, виділяється кисень об’ємом 4л (н.у.). Розрахуйте масову частку домішок в зразку нітрату. 3. Вкажіть рівняння окислювально-відновних реакцій: а) 2PH3 + 4O2 = P2O5 + 3H2O; б) P2O5 + H2O = 2HPO3; в) 4H3PO3 = 3H3PO4 + PH3; г) Ca3P2 + 6HCl = 3CaCl2 + 2PH3; д) PCl3 + 3H2O = H3PO3 + 3HCl. Варіант В. 1. Густину нітрогену визначено за повітрям. Якою формулою слід користуватися для обчислення його молекулярної маси: а) М = 28Д; в) М = 32Д; б) М = 29Д; г) М = 44Д? 2.Скільки оксиду фосфору (V) утворюється під час спалювання 62кг фосфору: а) 284кг; б) 142кг; в) 71кг; г) 2кг? 3. Фізичні властивості нітрогену і фосфору. Варіант С. 1. Дописати рівняння, якщо реакція можлива. Зазначивши умову перебігу кожної з них: 2. Чим відрізняється будова амонів ізотопів азоту 3. Вкажіть правильне розміщення електронів у енергетичних комірках і електронну формулу атома азоту: а) 1s2 2s2 2p3 ; б) 1s2 2s2 2p6 3s 2 3p3 ; в)
Т’юторські завдання. Обов’язкові Варіант А. 1. В 250г розчину з масовою часткою фосфорної кислоти 9,8% розчинили 14,2г оксиду фосфору (V). Обчислити масову частку H3 PO4 в добутому розчині. 2. Написати рівняння можливих реакцій: P2O5 + CaO ®; P2O5 + SiO2 ®; P2O5 + Na OH ®; P2O5 + K2O ®; P2O5 + SO3; P2O5 + H2O®; P2O5 + Ba(OH) ®; P2O5 + HNO3®. 3. У кисневих сполуках азот проявляє ступінь окислення від +1 до +5. Записати формули відповідних оксидів азоту. Варіант В. 1. 167мл азоту (н.у.) мають масу 0,21г. Врахувавши це й атомну масу азоту, обчислити число атомів у молекулі азоту. 2. Як здійснити такі перетворення: P ® P2O5 ® HPO3 ® NaPO3? 3. Реакція між азотом і воднем зображується таким термохімічним рівнянням: N2 + 3H2 Пояснити, в який бік і чому станеться зсув рівноваги: а) при збільшенні тиску; б) при підвищенні температури. Варіант С. 1. Обчислити масову частку азоту у його вищому оксиді. 2. Червоний фосфор окислюється азотною кислотою в присутності води за такою схемою: P + HNO3 + H2O ® H3PO4 = NO. Скласти рівняння цієї реакції, показати перехід електронів. Зазначити окислювач і відновник. 3. Дописати такі рівняння: P + O2 ®; P + S ®; P + Cl2 ®; P + Ca ®. Т’юторські завдання. Творчі 1. Нітроген і Фосфор – елементи V групи головної підгрупи. Чому на відміну від Фосфору, Нітроген не буває 5-валентним? 2. Суміш 3м3 азоту і 6м3 водню пропустили над каталізатором. Який об’єм аміаку утвориться? Який з двох газів подано в надлишку? Який об’єм його залишиться після реакції? Обчислити часову частку компонентів в суміші після реакції. Література 1. Алексюк А.М. Педагогіка вищої школи: Курс лекцій: модульне навчання. – К.: Вища школа, 1998. 2. Базелюк І.І. Організація групової самостійної роботи учнів на етапі засвоєння нових знань // Педагог.: Республ. наук. метод. зб-к. К.: Рад. шк., 1988. Вид 5, 117ст. 3. Базелюк І.І. Самостійна робота учнів на уроках органічної хімії. К., 1996, 91ст. 4. Буринська Н.М. Тестові завдання та вправи з неорганічної хімії. К.: “ОКО”, 1996, 203ст. 5. Буряк В.К. Самостоятельная работа учащихся. – М.: Просвещение, 1984, 64с. 6. Гареев В.М., Куликов С.И., Дурко Е.Н. Принципы модульного обучения // Вестник высшей школы. – 1987. - №8. – с.30-33. 7. Гольфарб Я.Л., Ходаков Ю.В. Збірник задач і вправ по хімії для середньої школи. Вид. 3. К.: Рад. шк., 1981. – 77ст. 8. Гончаренко С. Український педагогічний словник. – К.: Либідь. – 1997. – 376ст. 9. Громцева А.К. Формирование у школьников готовности к самообразованию. М.: Просвещение, 1983. – 144с. 10. Дидактика средней школы / Под ред. М.А. Данилова, М.Н. Скаткина. М.: Просвещение, 1982. – 319с. 11. Есипов Б.П. Самостоятельная работа учащихся на уроках. – М.: Учпедгиз, 1961. – 239с. 12. Жарова А.В. Управление самостоятельной деятельностью учащихся. – Л.: ЛГПИ им. А.И. Герцена, 1982. – 75с. 13. Жильцов П.А. Повышение эффективности учебно-воспитательного процеса. // Советская педагогика. – 1986. - №11. – с.63-69. 14. Занков Л.В. Дидактика и жизнь. М.: Просвещение, 1968. 230с. 15. Іванова Р.Г., Савич Т.З., Чертков І.Н. Самостійні роботи з хімії. – К.: Рад.шк., 1986. – 216ст. 16. Иванова Р.Г. Урок химии в средней школе. Типы, структура уроков химии и самостоятельная работа учащихся. – М.: Педагогика. – 88с. 17. Иванова Р.Г., Иодко А.Г. Система самостоятельных работ учащихся при изучении неорганической химии. – М.: Просвещение, 1988. – 160с. 18. Ильина Т.А. Тема обсуждения – педагогическая технология. // Вестник высшей школы – 1973. - №11. – с.13-17. 19. Карпова В.А. Об изучении фундаментальных дисциплин. в основе – бригадно- модульная структура. // Вестник высшей школы. – 1990. - №5. – с.47-48. 20. Кирюшин Д.М., Голобородько М.Я., Васик Г.Е. Методика самостоятельных работ на уроках химии в 7 классе. – М.: Просвещение, 1971. – 101с. 21. Кларк М. Технология образования или педагогическая технология? // Перспективы. Вопросы образования. – М., 1983. – 32. – с.47-54. 22. Коваленко О.Є. Методичні основи технології навчання: теоретико-методичні та практичні аспекти викладання дисциплін електроенерегтичного циклу. – Х.: Основа. – 1996. 23. Коваль Л.Г. Обгрунтування поняття “педагогічна технологія”. // Гуманітарні аспекти реформування і розвитку національної системи освіти. – К., 1994. – с.192-193. 24. Кузнецова Н.Е. Формирование систем понятий при обучении химии. – М.: Просвещение, 1989. – 144с. 25. Ларнер И.Я. Внимание технологии обучения // Советская пеадгогика. – 1990. - №3. – с.139-141. 26. Лында А.С. Дидактические основы формирования самоконтроля в процессе самостоятельной учебной работы учащихся. – М.: Высшая школа, 1979. – 159с. 27. Лозовая В.И. Познавательная активность школьников. – Харьков: Основа, 1990. –88с. 28. Организация проблемного обучения в школе. – М., 1977. – 240с. 29. Махмутов М.И. Современный урок. – М.: Педгогика, 1981. – 190с. 30. Мельник В.В. Наукове програмування навчального модуля. // Педагогіка і психологія. – 1997. – №1. – ст.71-79. 31. Нильсон О.А. Теория и практика самостоятельной работы учащихся в учебном процесе и ее эффективность при использовании рабочей тетради в школе. – Таллин: Валгус, 1976. – 280с. 32. Оконь В. Основы проблемного обучения. – М.: Просвещение, 1968. – 204с. 33. Пидкасистый П.И. Самостоятельно-познавательная деятельность школьников в обучении. – М.: Педагогика, 1980. – 240с. 34. Пидкасистый П.И. Самостоятельная деятельность учащихся. – 2-е изд. – М, 1981. – 78с. 35. Полосин В.С. Школьный експеримент по неорганической химии. – М.: Просвещение, 1970. – 336с. 36. Рева Ю.В. О груповой форме самостоятельной работы учащихся // Физика в школе. – 1987. - №1. – с. 46-47. 37. Сагарда В.В., Химинець О.В. Дидактичні передумови впровадження рейтингової системи оцінки успішності. // Рейтингова система оцінки успішності навчання. Збірник наукових праць. – К.: НМКВО. – 1992. – с.78-83. 38. Сікорський П.І. Модульно-рейтингова система навчання у ліцеї. // Педагогіка і психологія. – 1997. - №1. – с.71-79. 39. Суворцева Р.П., Савицкий С.Н., Иванова Р.Г. Задания по химии для самостоятельной работы учащихся. – М.: Просвещение, 1981. – 191с. 40. Уваров О.В., Чигриков В.И., Янцевич А.А. Модульный принцип организации учебного процеса. // Научно-методические аспекты совершенствования вузов. Материалы научно-методической конференции. – Харьков, 1992. – с.41-50. 41. Фальковская А.Ю., Петрова И.М. Самостоятельная работа по химии. М.: Высшая школа, 1978. – 77с. 42. Філіпчук Є.О., Ліщук М.Є Оновлення технології навчання та контролю знань. // Проблеми вищої школи. Науково-методичний збірник. – Випуск 81. – К.: Вища школа, 1994. – с.69-77. 43. Ходаков Ю.В., Етитейн Д.А., Глоріозов П.О. Викладання хімії в 9 класі. – К.: Рад. школа, 1972. – 157ст. 44. Хомченко Г.Л., Хомченко И.Г. Задачи по химии для поступления в вузы. – М.: Высшая школа, 1987. – 238с. 45. Химия в школе. Под ред. Прокофьева и Черткова И.Н. – М.: Просвещение, 1987. – 192с. 46. Цветкова Л.А. Преподавание органической химии в средней школе. – М.: Просвещение, 1988. – 240с. 47. Черемухина Г.В. Индивидуальная работа с учащимися по химии. М.: Просвещение, 1984. – 125с. 48. Шиян Н.І. Положення про технологію модульно-рейтингового навчання та визначення рейтингу студента. // Збірник статей всеукраїнської науково- методичної конференції з проблем природничих наук. – Полтава, 1998. – с.177- 183. 49. Шиян Н.І., Редчук А.С. Один з підходів до реорганізації шкільного курсу хімії. // Організація навчально-виховного процесу в середніх загальносвітніх закладах нового типу: досягнення, проблеми, перспективи. Матеріали всеукраїнської науково-практичної конференції. – Полтава, 1996. – с. 85-87. 50. Шиян Н.І., Самусенко Ю.В. Використання блочно-модульної системи навчання в школах нового типу. // організація навчально-виховного процесу в середніх загальноосвтніх закладах нового типу: досягнення, проблеми, перспективи. Матеріали всеукраїнської науково-практичної конференції. – Полтава, 1996. –с. 333-334. 51. Шиян Н.І.Формування цілісного природничо-наукового світорозуміння під час вивчення хімії. // Інтеграція елементів змісту освіти. Матеріали всеукраїнської науково-практичної конференції. – Полтава, 1994. – с.124-125. 52. Ярошенко О.Г., Новицька В.І. Збірник задач і вправ по хімії. Навчальний збірник. вид. 2-е. – К.: Станіца, 1996. – 144с. 53. Ярошенко О.Г. Групова навчальна діяльність школярів: теорія і методика (на матеріалі вивчення хімії). – К.: Партнер, 1997. – 208с. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
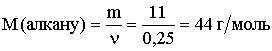
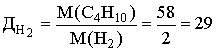
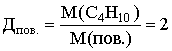 .
.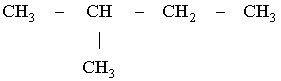 ;
;